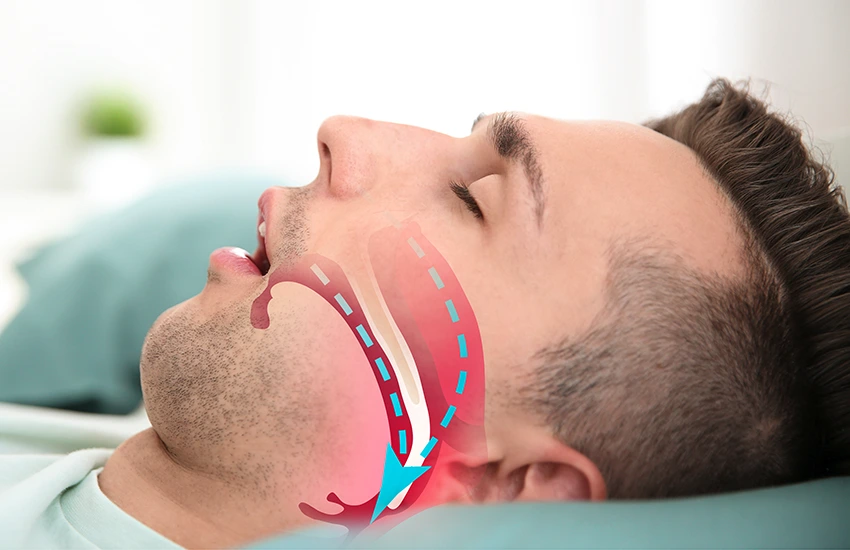
Bezdech senny dzieli się na dwie główne formy: obturacyjną (OBS), związaną z blokadą dróg oddechowych, oraz centralną (CBS), wynikającą z zaburzeń ośrodka oddechowego w mózgu. Poniżej przedstawiono kompleksową analizę mechanizmów prowadzących do obu typów bezdechu sennego – od czynników anatomicznych i neurologicznych po metaboliczne, stylu życia, genetyczne oraz inne rzadsze mechanizmy – wraz z omówieniem powiązanych czynników ryzyka i reakcji kompensacyjnych organizmu.
Obturacyjny bezdech senny (OBS)
OBS charakteryzuje się okresowym zapadaniem górnych dróg oddechowych podczas snu, mimo kontynuowania wysiłku oddechowego przez pacjenta. Dochodzi do częściowego lub całkowitego zamknięcia gardła, co skutkuje spadkiem przepływu powietrza, epizodami niedotlenienia i mikro-wybudzeniami ze snu (1) (2). Patogeneza jest wieloczynnikowa – na wystąpienie OBS wpływają zarówno cechy anatomiczne (budowa dróg oddechowych), jak i kontrola nerwowo-mięśniowa mięśni gardła, a także czynniki metaboliczne i styl życia (3 ). Innymi słowy, konieczne jest współwystępowanie predyspozycji anatomicznych oraz nieadekwatnej kompensacji neuromięśniowej, aby podczas snu doszło do zamknięcia dróg oddechowych ( 4) (5). Poniżej omówiono najważniejsze grupy przyczyn OBS:
Anatomiczne predyspozycje
- Nieprawidłowa budowa górnych dróg oddechowych: Wrodzone lub nabyte cechy anatomiczne mogą zwężać światło gardła. Należą do nich m.in. skrót żuchwy lub retrognacja (co zmniejsza przestrzeń dla języka), wydłużona twarzoczaszka, hipoplazja żuchwy, nisko położona kość gnykowa czy przerost tkanek gardła (6). Zwłaszcza przerost migdałków podniebiennych i adenoidalnych (gardłowego) oraz makroglosja (powiększony język) powodują mechaniczne zwężenie gardła i zwiększają podatność na jego zapadanie się podczas snu (7).
- Zwiększona masa tkanek miękkich w okolicy szyi: Osoby z otyłością często mają nadmiar tkanki tłuszczowej wokół szyi i w obrębie gardła. Tłuszcz zgromadzony w okolicy szyi zmniejsza wewnętrzny przekrój dróg oddechowych i wywiera nacisk na ściany gardła (8) (9). Skutkiem tego jest wzrost podatności na zapadanie się wiotkich struktur gardła. Badania pokazują, że otyłość (zwłaszcza trzewna) i większy obwód szyi są silnymi czynnikami ryzyka OBS (10). Nadmiar tkanki tłuszczowej może także odkładać się w języku i okolicy podniebienia miękkiego, dodatkowo zwężając gardło (11).
- Inne cechy anatomiczne: Osoby z większym obwodem szyi, krótszą i grubszą szyją mają względnie węższe drogi oddechowe. Również zmiany anatomii nosa (np. skrzywienie przegrody, polipy) utrudniają swobodny przepływ powietrza i sprzyjają oddychaniu przez usta, co może nasilać podatność gardła na zapadanie (choć główną rolę gra tu gardło). U dzieci dominującą anatomiczną przyczyną OBS bywa przerost migdałków i adenoidów.
Czynniki neurologiczne
- Obniżone napięcie mięśni gardła podczas snu: Podczas czuwania nawet osoby z predyspozycjami anatomicznymi potrafią utrzymać drożność gardła dzięki odruchowemu zwiększeniu aktywności mięśni rozwierających gardło. W czasie snu dochodzi jednak u wszystkich do zmniejszenia napięcia mięśniowego. Jeśli u danej osoby mechanizmy nerwowo-mięśniowe są niewystarczające, następuje zapadnięcie się wiotkiego gardła (12 ). U zdrowych osób obserwuje się silne odruchowe pobudzenie mięśni gardła przy grożącej obturacji, co chroni je przed bezdechem, natomiast u pacjentów z OBS ta odpowiedź kompensacyjna jest słabsza (13). Innymi słowy, deficyt neuromięśniowej kontroli dróg oddechowych (np. słabsza reakcja mięśni na rozciąganie czy opóźniona reakcja na hipowentylację) współdziała z niekorzystną anatomią w powodowaniu OBS (14).
- Choroby i uszkodzenia neurologiczne: Schorzenia, które osłabiają unerwienie lub siłę mięśni oddechowych, zwiększają ryzyko OBS. Udar mózgu (zwłaszcza pnia mózgu) może upośledzić kontrolę oddechu i napięcie mięśni gardła, sprzyjając zarówno bezdechom obturacyjnym, jak i centralnym. Polineuropatie (np. w cukrzycy) uszkadzające nerwy obwodowe zaopatrujące mięśnie górnych dróg oddechowych również mogą przyczyniać się do OBS. Podobnie choroby nerwowo-mięśniowe jak miastenia czy zespoły miopatyczne osłabiają mięśnie gardła. Przykładowo, OBS stwierdza się u części pacjentów po urazie rdzenia kręgowego (przerwanie dróg nerwowych kontrolujących oddech) (15). We wszystkich tych przypadkach zasadniczy mechanizm polega na niedostatecznej aktywności mięśni poszerzających drogi oddechowe podczas snu, co w połączeniu z siłą ssącą wdechu prowadzi do zapadania ścian gardła.
Czynniki metaboliczne i hormonalne
- Otyłość i zespół metaboliczny: Otyłość została już wymieniona jako kluczowa anatomiczna predyspozycja, ale jest też częścią szerszego obrazu metabolicznego. Osoby otyłe często mają insulinooporność, stan zapalny i zatrzymanie wody, co może powodować obrzęk tkanek (np. śluzówki gardła). Zespół metaboliczny i cukrzyca typu 2 korelują z częstszym występowaniem OBS (16). Istnieją dowody, że redukcja masy ciała zmniejsza nasilenie bezdechów, co potwierdza rolę czynników metabolicznych.
- Niedoczynność tarczycy: Ciężka niedoczynność tarczycy może powodować odkładanie się glikozaminoglikanów w tkankach (tzw. obrzęk śluzowaty) – prowadzi to m.in. do pogrubienia i obrzęku śluzówki gardła oraz powiększenia języka. Dodatkowo spowalnia metabolizm i może zmniejszać napęd oddechowy. Te zmiany sprzyjają powstawaniu bezdechów obturacyjnych (17). U pacjentów z niedoczynnością tarczycy często stwierdza się OBS, który może częściowo ustępować po leczeniu tyroksyną.
- Akromegalia: Nadmiar hormonu wzrostu u dorosłych powoduje przerost tkanek miękkich (powiększenie języka, małżowin nosowych, pogrubienie rysów twarzy) oraz przerost kości twarzoczaszki (np. żuchwy). Te zmiany anatomiczne zwężają drogi oddechowe. Wskutek akromegalii często rozwija się zespół bezdechu sennego – szacuje się, że nawet 40–60% pacjentów z akromegalią cierpi na OBS z powodu zmian kostnych i tkanek miękkich gardła (18).
- Inne zaburzenia hormonalne: Zespół policystycznych jajników (PCOS) u kobiet bywa łączony z częstszym występowaniem OBS (prawdopodobnie z powodu otyłości brzusznej i insulinooporności). Menopauza – spadek ochronnego działania estrogenów może częściowo tłumaczyć, czemu po menopauzie wzrasta częstość OBS u kobiet, zbliżając się do poziomu u mężczyzn.
Czynniki stylu życia
- Spożycie alkoholu: Alkohol działa relaksująco na mięśnie szkieletowe, w tym mięśnie gardła. Wypicie alkoholu przed snem powoduje więc silniejsze rozluźnienie mięśni podniebienia miękkiego i języka, co zwiększa ryzyko zapadania się gardła. Alkohol dodatkowo obniża reakcję pobudzenia mózgu na niedotlenienie, więc wydłuża epizody bezdechu. Badania potwierdzają, że spożycie alkoholu zaostrza objawy OBS i zwiększa częstość bezdechów (19).
- Palenie tytoniu: Palacze mają większe ryzyko OBS. Dym tytoniowy powoduje przewlekłe zapalenie dróg oddechowych i obrzęk śluzówki gardła oraz krtani. Obrzęk i przekrwienie ścian gardła zmniejszają jego światło. Ponadto palenie sprzyja odkładaniu tkanki tłuszczowej centralnie (wokół szyi). Rzucenie palenia może zmniejszyć objawy chrapania i bezdechów.
- Leki uspokajające i nasenne: Środki działające depresyjnie na ośrodkowy układ nerwowy (nasenne, benzodiazepiny) pogłębiają fizjologiczne zwiotczenie mięśni podczas snu i osłabiają odruchy obronne. Nawet typowe dawki mogą nasilać obturacje u osób podatnych. Szczególnie niebezpieczne jest łączenie leków nasennych z alkoholem lub opioidami.
- Pozycja podczas snu: Spanie na wznak (na plecach) sprzyja zapadaniu się języka i podniebienia ku tylnej ścianie gardła pod wpływem grawitacji. U wielu pacjentów OBS bezdechy występują głównie w pozycji na plecach, a zmiana pozycji na boczną poprawia drożność. Dlatego zaleca się pacjentom tzw. terapię pozycyjną (unikanie pozycji na plecach). Z kolei spanie na boku lub na brzuchu zmniejsza ryzyko obturacji.
Choroby współistniejące
- Choroby sercowo-naczyniowe: OBS często współwystępuje z nadciśnieniem tętniczym, chorobą wieńcową i migotaniem przedsionków. Wiele z tych zależności ma charakter dwukierunkowy. Z jednej strony nawracające niedotlenienia i pobudzenie układu współczulnego w OBS przyczyniają się do rozwoju nadciśnienia i arytmii. Z drugiej strony, u pacjentów kardiologicznych częściej stwierdza się bezdechy – np. migotanie przedsionków wiąże się z częstszym OBS (być może z powodu wspólnych czynników ryzyka, jak otyłość) (20). Przewlekła niewydolność serca może powodować zarówno OBS, jak i bezdech centralny (patrz niżej); w kontekście OBS mechanizmem może być przesiąkanie płynu do tkanek szyi w pozycji leżącej (tzw. rostralny przepływ płynów), co prowadzi do obrzęku okolic gardła i jego zwężenia w nocy (21).
- Choroby układu oddechowego: Przewlekła obturacyjna choroba płuc (POChP) może współistnieć z OBS, dając tzw. zespół nakładania. Przewlekłe niedotlenienie w POChP i zatrzymanie CO₂ w nocy mogą zmieniać chemorefleksy oddechowe. Ponadto ograniczony przepływ powietrza w dolnych drogach oddechowych może pogłębiać podciśnienie w gardle podczas wdechu, sprzyjając zapadaniu. Pacjenci z astmą oskrzelową i POChP często chrapią, a leczenie (np. sterydy wziewne) zmniejszając stan zapalny dróg oddechowych może poprawić też objawy snu.
- Zespoły uwarunkowane genetycznie: Niektóre choroby genetyczne wiążą się z otyłością i hipotonią mięśni, co predysponuje do OBS. Przykładem jest zespół Pradera-Williego (otyłość, hipotonia, hipogonadyzm) oraz zespół Downa. W zespole Downa typowe cechy (niskie napięcie mięśniowe, krótka szyja, mała żuchwa oraz powiększony język) występują jednocześnie, stąd bezdech senny jest bardzo częsty u osób z trisomią 21 (22).
Czynniki genetyczne
Poza wymienionymi zespołami genetycznymi, sam idiopatyczny zespół OBS również ma podłoże dziedziczne. Predyspozycje do określonej budowy twarzoczaszki, rozmieszczenia tkanki tłuszczowej czy regulacji oddechu mogą być warunkowane genetycznie. Szacuje się, że około 40% wariabilności nasilenia OBS (np. wskaźnika AHI) wynika z czynników genetycznych (23). Bliscy krewni osób z OBS chorują częściej, nawet po uwzględnieniu wpływu otyłości, wieku i płci (24 ). Identyfikuje się również konkretne polimorfizmy genów związane z otyłością czy strukturą dróg oddechowych, które zwiększają podatność na bezdechy (25). W praktyce oznacza to rodzinne występowanie OBS – jeśli np. rodzic cierpi na ciężki bezdech senny, dzieci mają większe ryzyko zachorowania w przyszłości.
Inne mechanizmy i reakcje kompensacyjne przy OBS
- Obniżony próg pobudzenia (arousal threshold): U niektórych pacjentów z OBS mózg bardzo szybko wybudza się przy niewielkim niedotlenieniu lub wzroście oporów oddechowych. Paradoksalnie niski próg pobudki może sprzyjać większej fragmentacji snu i uniemożliwiać osiągnięcie głębokiego snu, co utrudnia utrzymanie stałego napięcia mięśni gardła. Z drugiej strony, zbyt wysoki próg pobudzenia (trudność w wybudzeniu) powoduje dłuższe trwanie bezdechu i głębsze niedotlenienie zanim nastąpi przebudzenie. Zatem indywidualne różnice w reaktywności mózgu na bezdech wpływają na obraz kliniczny – to jeden z mechanizmów różnicujących fenotypy OBS.
- Wzrost aktywności współczulnej: Każdy epizod bezdechu prowadzi do spadku saturacji i wzrostu stężenia CO₂, co silnie pobudza układ współczulny (tzw. reakcja „walcz lub uciekaj”). Następuje wyrzut katecholamin, przyspieszenie akcji serca i skurcz naczyń – jest to mechanizm kompensacyjny, który ma utrzymać perfuzję ważnych narządów w warunkach niedotlenienia (26) (27). Niestety, przewlekle podwyższona aktywność współczulna prowadzi do nadciśnienia tętniczego i innych powikłań sercowo-naczyniowych często stwierdzanych u pacjentów z OBS.
- Mikroprzebudzenia i wzrost napięcia mięśni: Kluczowym mechanizmem obronnym organizmu jest wybudzenie się (choćby krótkie) w odpowiedzi na zamknięcie dróg oddechowych. Towarzyszy temu gwałtowne przywrócenie napięcia mięśni gardła i przełamanie obturacji – pacjent często chrząka, sapie lub głośno chrapie gdy powietrze przedziera się przez zwężenie przy powrocie oddechu. Te przebudzenia ratują przed długotrwałą asfiksją, lecz prowadzą do fragmentacji snu. W ciągu jednej nocy chory na ciężki OBS może doświadczyć dziesiątek takich mikrowybudzeń, co uniemożliwia osiągnięcie regenerującego, głębokiego snu (28).
- Zmiany adaptacyjne w ciągu doby: Organizm może częściowo adaptować się do nawracających bezdechów. Np. dochodzi do wzrostu czułości chemoreceptorów na CO₂ i O₂ – przez co w dzień pacjent może mieć nieco szybszy oddech (hyperwentylację kompensacyjną) w odpowiedzi na nocne zatrzymania oddechu. U niektórych chorych obserwuje się też wtórną poliglobulię (zwiększenie liczby krwinek czerwonych) jako reakcję na przewlekłe niedotlenienie nocy, choć nie jest to regułą w OBS (częściej w chorobach płuc).
Centralny bezdech senny (CBS)
W centralnym bezdechu sennym głównym problemem nie jest mechaniczna blokada dróg oddechowych, lecz przejściowy brak impulsu oddechowego z ośrodka oddechowego. Mózg (pień mózgu) okresowo przestaje wysyłać sygnały do mięśni oddechowych, przez co zanika zarówno przepływ powietrza, jak i wysiłek oddechowy – klatka piersiowa nie wykonuje ruchu przy próbie wdechu (29) (30). Epizody te trwają zwykle kilkanaście sekund lub dłużej i kończą się ponownym uruchomieniem oddechu (często hiperwentylacją). CBS jest znacznie rzadszy niż OBS, stanowi jednak istotny problem u osób z pewnymi schorzeniami, zwłaszcza kardiologicznymi i neurologicznymi (31). Wyróżnia się różne typy CBS, m.in. bezdech centralny idiopatyczny, CBS z oddychaniem Cheyne’a-Stokesa, CBS wtórny do chorób (np. neurologicznych), CBS wysokościowy czy CBS polekowy, a także CSA emergentny przy leczeniu OBS (32). Poniżej opisano główne przyczyny i mechanizmy centralnych bezdechów sennych:
Zaburzenia ośrodka oddechowego w mózgu
- Uszkodzenie struktur pnia mózgu: Ośrodek oddechowy znajduje się w rdzeniu przedłużonym i mostku. Uszkodzenia tych struktur mogą znosić prawidłowy napęd oddechowy. Udar niedokrwienny lub krwotoczny pnia mózgu (szczególnie w okolicy opuszkowej) jest jedną z przyczyn nabytych bezdechów centralnych – pacjent po takim udarze może mieć nieregularny oddech w czasie snu lub nawet w czuwaniu. Guz mózgu naciskający na pień, uraz głowy czy zapalenie mózgu (encefalitis) to kolejne możliwe przyczyny uszkodzenia ośrodka oddechowego (33). Także malformacja Chiari II (wrodzone wklinowanie móżdżku i pnia w otwór potyliczny) może manifestować się bezdechami centralnymi już u noworodków (34). We wszystkich tych przypadkach dochodzi do hipowentylacji – mózg nie „każe” oddychać wystarczająco mocno, co skutkuje zatrzymaniem oddechu podczas snu, gdy brak jest bodźców czuwania.
- Zmniejszona wrażliwość chemiczna na CO₂: U zdrowej osoby wzrost stężenia CO₂ we krwi jest głównym bodźcem do oddychania – chemoreceptory w mózgu i kłębkach szyjnych stymulują głębszy oddech. Jeśli próg wrażliwości na CO₂ jest podwyższony (czyli organizm „toleruje” wyższe CO₂ bez uruchomienia oddechu), może dochodzić do centralnych pauz oddechowych. Taka zmniejszona wrażliwość bywa cechą idiopatyczną u niektórych osób, ale też pojawia się u pacjentów przewlekle retencyjnych (np. w POChP z hiperkapnią, choć tam częściej występuje hipowentylacja w czuwaniu niż czyste bezdechy we śnie). Podczas snu napęd oddechowy i tak spada u każdego – jeśli u kogoś jest on już niski, może dojść do zatrzymania oddechu nawet bez przeszkody w gardle.
- Wrodzone zaburzenia centralnej kontroli oddechu: Najrzadszym, ale dramatycznym przykładem jest wrodzony zespół hipowentylacji centralnej (CCHS), zwany też klątwą Ondyny. Jest to choroba genetyczna (mutacje w genie PHOX2B) powodująca, że noworodek nie podejmuje oddechu podczas snu (35). Dziecko musi być wspomagane respiratorem podczas snu, choć na jawie oddycha samo. Łagodniejsze fenotypy mogą ujawnić się później w życiu, np. jako tendencja do bezdechów sennych o typie centralnym (36). To skrajny przykład utraty centralnej kontroli oddechu. Inny bardzo rzadki zespół to ROHHAD (szybko narastająca otyłość z dysfunkcją podwzgórza i hipowentylacją), w którym również występują bezdechy centralne o złożonej patogenezie (37).
Choroby neurologiczne
- Choroby neurodegeneracyjne: Choroba Parkinsona i inne parkinsonizmy mogą zaburzać regulację oddechu poprzez zmiany zwyrodnieniowe w pniu mózgu. U części pacjentów z Parkinsonem stwierdza się epizody bezdechu centralnego – mózg nie zawsze wysyła sygnał do oddechu, co może być związane z utratą neuronów odpowiadających za rytm oddechowy. Dodatkowo leki stosowane w Parkinsonie (opioidowe leki przeciwbólowe, nasenne) mogą nasilać te zaburzenia.
- Stwardnienie zanikowe boczne (ALS): W ALS dochodzi do postępującego uszkodzenia neuronów ruchowych, w tym unerwiających mięśnie oddechowe (przeponę, mięśnie międzyżebrowe) oraz potencjalnie ośrodków oddechowych. Zaawansowani pacjenci z ALS mają niewydolność oddechową i często wymagają wspomagania oddechu. Podczas snu mogą występować u nich zarówno bezdechy obturacyjne (z powodu osłabienia mięśni gardła), jak i centralne (z powodu dysfunkcji ośrodka oddechowego). W klinicznej praktyce u chorego z ALS obserwuje się hipowentylację nocną, płytki oddech i epizody braku oddechu, co wynika z połączenia obu mechanizmów.
- Inne choroby: Stwardnienie rozsiane (gdy zmiany demielinizacyjne uszkodzą pień mózgu) czy pląsawica Huntingtona (neurodegeneracja) również mogą w rzadkich przypadkach powodować centralne zaburzenia oddychania podczas snu. Ogólnie, każdy proces neurologiczny, który pogorszy automatyczną kontrolę oddechu lub unerwienie mięśni oddechowych, może skutkować CBS.
Oddychanie Cheyne’a-Stokesa i niewydolność serca
Jedną z najważniejszych przyczyn nabytych bezdechów centralnych jest oddsychanie okresowe typu Cheyne’a-Stokesa (CS), zwykle występujące u pacjentów z ciężką niewydolnością serca. Oddech Cheyne’a-Stokesa charakteryzuje się naprzemiennymi okresami hiperwentylacji i bezdechu (lub znacznego spłycenia oddechu) o narastającej i opadającej amplitudzie oddechu (38). Mechanizm polega na opóźnionej informacji zwrotnej w układzie krążenia: w niewydolnym sercu krew wolniej dociera do mózgu. Gdy pacjent doświadcza bezdechu, CO₂ we krwi rośnie – organizm reaguje z opóźnieniem dopiero, gdy ta „przepełniona CO₂” krew dotrze do chemoreceptorów mózgowych, wywołując gwałtowną hiperwentylację. Następnie, na skutek hiperwentylacji, spada poziom CO₂ (hipokapnia) poniżej progu pobudzenia oddechu i znów następuje kilka sekund bezdechu. Ten cykl powtarza się regularnie, tworząc charakterystyczny wykres przypominający sinusoidę (narastające i opadające oddechy przedzielone pauzą) (39). Bezdechy w Cheyne–Stokesie są centralne – nie ma wysiłku oddechowego w przerwie. Występują one nawet u 15–30% pacjentów z niewydolnością serca i są złym czynnikiem rokowniczym (40). Konsekwencją CS bywa przewlekła stymulacja układu współczulnego (na skutek powtarzających się bezdechów), co dodatkowo obciąża i tak już chory mięsień sercowy (41). Leczenie niewydolności serca (farmakologiczne, przeszczep LVAD) często łagodzi oddychanie Cheyne’a-Stokesa. Warto dodać, że podobny mechanizm okresowego oddychania może wystąpić u osób ze ciężką chorobą nerek (mocznik wpływa na chemoreceptory) lub udarami wieloogniskowymi, ale najczęstszy jest w niewydolności serca.
Używki i leki
- Opioidy: Są jedną z wiodących odwracalnych przyczyn centralnego bezdechu. Opioidowe leki przeciwbólowe (morfina, oksykodon, metadon itp.) silnie hamują ośrodek oddechowy w pniu mózgu. Prowadzi to do spłycenia oddechu, zmniejszenia częstotliwości oraz epizodów bezdechu centralnego, zwłaszcza podczas snu (42). U pacjentów przewlekle przyjmujących opioidy (np. z bólem nowotworowym czy przewlekłym bólem) obserwuje się wysoką częstość centralnych zaburzeń oddychania – jest to tzw. opioid-induced sleep apnea. Badania wskazują, że nawet 30% osób na przewlekłej terapii opioidami ma istotne bezdechy centralne (43). Mechanizm polega na zmniejszeniu wrażliwości ośrodka oddechowego na CO₂ (pod wpływem opioidów organizm „przeocza” wzrost CO₂ i nie zwiększa wentylacji).
- Benzodiazepiny i środki nasenne: Choć benzodiazepiny głównie działają poprzez nasilenie OBS (relaksacja mięśni), w wyższych dawkach mogą też osłabić napęd oddechowy. Niektóre leki nasenne (zwłaszcza stare barbiturany) tłumią ośrodek oddechowy. W praktyce klinicznej izolowany CBS polekowy najczęściej dotyczy opioidów; benzodiazepiny natomiast mogą pogarszać przebieg mieszanych bezdechów (wydłużając epizody).
- Substancje psychoaktywne: Nadużycie alkoholu poza OBS może też wywołać komponentę centralną – głęboka intoksykacja alkoholowa powoduje depresję układu nerwowego i oddechowego (stąd zagrożenie ostrą niewydolnością oddechową u upojonych). Poalkoholowe bezdechy centralne są jednak zjawiskiem ostrym; przewlekli alkoholicy raczej cierpią na OBS przez miopatię i polineuropatię niż na czysty CBS. Niektóre narkotyki sedacyjne (np. GHB) również mogą powodować bezdechy centralne.
Wpływ wysokogórskiego środowiska
Przebywanie na dużej wysokości (powyżej ~2500 m n.p.m.) wywołuje u zdrowych osób zjawisko oddychania okresowego wysokościowego. W obniżonej prężności tlenu organizm reaguje przyspieszeniem i pogłębieniem oddechu (hiperwentylacją) w celu utrzymania utlenowania krwi. Jednak hiperwentylacja obniża stężenie CO₂ (wywołując alkalozę oddechową), co z kolei hamuje ośrodek oddechowy. Efektem są epizody centralnych bezdechów przerywanych westchnieniami i okresami szybkiego oddechu – czyli klasyczne okresowe oddychanie. W nocy na dużej wysokości prawie każdy doświadcza takich centralnych bezdechów (są one częścią procesu aklimatyzacji) (44). Zwykle po 1-2 nocach organizm częściowo się adaptuje: nerki zmniejszają produkcję wodorowęglanów (kompensacja alkalozy), co przywraca wrażliwość na CO₂, i bezdechy stają się rzadsze. Jednak pełna aklimatyzacja nie zawsze eliminuje problem – u niektórych osób oddychanie periodyczne utrzymuje się przez cały pobyt na wysokości (45). Centralny bezdech wysokościowy jest też nazywany oddychaniem Cheyne’a-Stokesa na wysokości, choć mechanizm wynika głównie z hipokapnii wysokościowej, a nie niewydolności serca. Z medycznego punktu widzenia są to odwracalne bezdechy – po zejściu na niziny ustępują samoistnie.
Inne mechanizmy i mechanizmy kompensacyjne przy CBS
- Wysoki “loop gain” układu oddechowego: Termin loop gain odnosi się do stabilności układu sprzężenia zwrotnego kontrolującego oddychanie. Wysoki loop gain oznacza, że układ oddechowy reaguje nadmiernie silnie na nawet niewielkie odchylenia gazometryczne – prowadzi to do oscylacji. Jest to odwrotność stabilnego działania. U pacjentów z centralnym bezdechem (np. w niewydolności serca) często stwierdza się zwiększoną wrażliwość na CO₂ i O₂, co skutkuje właśnie niestabilnym oddechem i periodycznymi bezdechami (46) (47). Mówiąc prościej, nadmiernie “czujny” ośrodek oddechowy powoduje, że oddech łatwo wpada w oscylacje hiperwentylacja/bezdech. Ten mechanizm tłumaczy czemu niektórzy pacjenci mają centralne bezdechy mimo braku uszkodzenia mózgu – to kwestia regulacji. Z drugiej strony, niski loop gain (mała wrażliwość na zmiany) sprzyja hipowentylacji i też może dawać bezdechy, choć częściej po prostu prowadzi do przewlekłej hiperkapnii.
- Mechanizmy kompensacyjne odruchów: W centralnym bezdechu organizm polega głównie na chemicznych bodźcach do wznowienia oddechu. Gdy przerwa w oddychaniu powoduje wzrost CO₂ do pewnego progu pobudzenia, ośrodek oddechowy znów zaczyna działać i pacjent “automatycznie” wykonuje głęboki wdech (często z westchnieniem). Tym samym naprzemienne spadki i wzrosty CO₂ sterują oddychaniem. Pewną rolę odgrywają też odruchy z mechanoreceptorów płuc i klatki piersiowej – np. jeśli płuca się zapadają (brak ruchu oddechowego), może to pobudzać oddech. Jednak kluczowym czynnikiem jest tu chemiczna kontrola oddechu. W przeciwieństwie do OBS, w czystym CBS brak jest potrzeby przebudzenia się do przywrócenia oddechu – oddychanie wznawia się zwykle bez wybudzenia, gdy tylko chemiczny bodziec osiągnie próg. Dlatego pacjent z CBS często nie jest świadomy przerw (brak gwałtownych wybudzeń jak przy OBS).
- Bezdech centralny emergentny przy leczeniu OBS: Ciekawym zjawiskiem jest tzw. złożony bezdech senny (complex sleep apnea), gdy u pacjenta z dominującym OBS pojawiają się dodatkowo bezdechy centralne po założeniu CPAP. CPAP usuwa obturacje, ale jednocześnie nagłe polepszenie utlenowania i wypłukanie CO₂ może spowodować, że oddech zostaje chwilowo zahamowany przez ośrodek oddechowy (mózg „uznaje”, że może zrobić przerwę). Powstają wtedy centralne pauzy – jest to przejściowe zjawisko adaptacji układu oddechowego do nowej sytuacji. U większości pacjentów te emergentne bezdechy centralne zanikają po kilku dniach tygodniach terapii PAP, gdy organizm dostosuje chemorefleksy. Jeśli się utrzymują, czasem wymaga to zmiany ustawień aparatu (np. wentylacja ASV). Mechanizm ten pokazuje, jak usunięcie jednej przyczyny bezdechu (obturacji) może ujawnić utajoną niestabilność centralnej kontroli oddechu.
- Adaptacja organizmu: W centralnych zaburzeniach oddychania również obserwuje się pewne adaptacje. Przykładowo, u osób przebywających długotrwale na wysokości organizm zwiększa produkcję erytropoetyny i ilość krwinek czerwonych, aby kompensować nocne epizody hipoksji. W niewydolności serca organizm uruchamia mechanizmy neurohormonalne (RAA, sympatyczne) w odpowiedzi na stres bezdechów, aczkolwiek na dłuższą metę są one szkodliwe dla serca. W idiopatycznych centralnych bezdechach organizm może przez lata tolerować lekko niestabilny oddech bez większych następstw, dopóki nie pojawią się czynniki zaostrzające (np. wiek, leki). Interesująco, osoby starsze mają większą skłonność do bezdechów centralnych niż młodsze – prawdopodobnie dlatego, że z wiekiem rośnie wrażliwość na CO₂ (co można traktować jako maladaptację układu oddechowego) (48) (49).
Podsumowując, bezdech senny jest schorzeniem o złożonej etiologii. W obturacyjnym bezdechu ścierają się czynniki mechaniczne (anatomiczne) i czynnościowe (neuromięśniowe, styl życia, choroby), prowadząc do zapadania się gardła podczas snu. Natomiast centralny bezdech wynika z niewydolności lub rozchwiania centralnej regulacji oddechu, często na tle chorób serca, uszkodzeń mózgu lub działania leków. W obu typach występują charakterystyczne mechanizmy kompensacyjne: w OBS – gwałtowne wybudzenia i wzrost napięcia mięśni oraz aktywacji układu współczulnego, a w CBS – automatyczna regulacja chemiczna powodująca okresowe wznowienie oddechu. Wielu pacjentów ma komponenty mieszane obu typów bezdechu (np. OBS nasilający się w fazie REM i epizody centralne w NREM przy Cheyne-Stokes) (50f). Zrozumienie przyczyn i mechanizmów bezdechu sennego pozwala na lepsze ukierunkowanie leczenia – od modyfikacji stylu życia i leczenia schorzeń towarzyszących, po odpowiednią terapię aparatem CPAP/ASV czy leczenie farmakologiczne konkretnych przyczyn (np. odstawienie opioidów, wyrównanie niedoczynności tarczycy). Dzięki intensywnym badaniom naukowym coraz lepiej poznajemy te mechanizmy (np. rolę loop gain czy genetyki) i możemy skuteczniej pomagać pacjentom z tym złożonym zaburzeniem (51) (52).